Enthalpy là lượng nhiệt mà hệ thống nhiệt động giải phóng hoặc hấp thụ từ môi trường xung quanh. Vậy tính biến thiên enthalpy của phản ứng hóa học như thế nào? Cách xác định biến thiên enthalpy của phản ứng hóa học dựa vào năng lượng liên kết và dựa vào enthalpy tạo thành như thế nào? Mời các bạn cùng tìm hiểu qua bài 14 nhé!
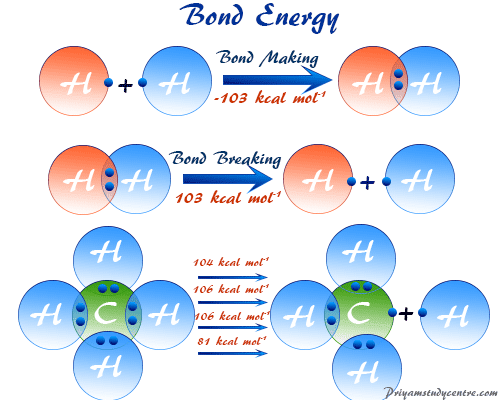 |
| Năng lượng liên kết hóa học |
1. Xác định biến thiên enthalpy của phản ứng dựa vào năng lượng liên kết
- Phản ứng hóa học xảy ra khi có sự phá vỡ các liên kết hoá học của chất đầu (cđ) và hình thành các liên kết hoá học của sản phẩm (sp). Sự phá vỡ các liên kết cần cung cấp năng lượng, sự hình thành các liên kết lại giải phóng năng lượng.
- Tính biến thiên enthalpy của phản ứng hóa học dựa vào năng lượng liên kết được áp dụng cho phản ứng trong đó các chất đều có liên kết cộng hoá trị ở thể khí khi biết giá trị năng lượng liên kết của tất cả các chất trong phản ứng.
- Đối với phân tử nhiều nguyên tử, năng lượng liên kết là giá trị trung bình của năng lượng các liên kết trong phân tử.
 |
| Sự hình thành phân tử nước |
2. Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành
- Cho phương trình hoá học tổng quát:
aA + bB → mM + nN
- Có thể tính được biến thiên enthalpy chuẩn của một phản ứng hoá học (∆r H0298) khi biết các giá trị ∆f H0298 của tất cả các chất đầu và sản phẩm theo công thức sau:
∆r H0298= m × ∆f H0298 (M) + n × ∆f H0298 (N) – a× ∆f H0298 (A) – b × ∆f H0298 (B) (2)
- Khi tính giá trị biến thiên enthalpy của phản ứng thì cần nhân hệ số tỉ lượng với enthalpy tạo thành của các chất tương ứng.
 |
| Xác định biến thiên enthalpy của phản ứng dựa vào enthalpy tạo thành |
Hướng dẫn giải bài tập
Bài 1. Tính ∆r H0298 của các phản ứng sau dựa theo năng lượng liên kết (sử dụng số liệu từ Bảng 14.1):
a) N2H4(g) → N2(g) + 2H2(g)
b) 4HCl(g) + O2(g) (t0)→2Cl2(g) + 2H2O(g)
Giải:
a) N2H4(g) → N2(g) + 2H2(g)
Ta có:
∆r H0298 = ΣEb(cđ) - ΣEb(sp)
= Eb(N2H4) – Eb(N2) – 2xEb(H2)
= Eb(N-N) + 4xEb(N-H) – Eb(N≡N) - 2xEb(H-H)
= 418 + 4 x 391 - 945 - 2 x 432 = 173 kJ
b) 4HCl(g) + O2(g) (to)→2Cl2(g) + 2H2O(g)
∆r H0298 = ΣEb(cđ) - ΣEb(sp)
= 4 x Eb(HCl) + Eb(O2) – 2 x Eb(Cl2) – 2.Eb(H2O)
= 4 x Eb(H-Cl) + Eb(O=O) – 2 x Eb(Cl-Cl) - 2 x 2 x Eb(O-H)
= 4 x 427 + 498 – 2 x 243 – 2 x 2 x 467 = -148 kJ
Bài 2. Dựa vào Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng đốt cháy hoàn toàn 1 mol benzene C6H6(l) trong khí oxygen, tạo thành CO2(g) và H2O(l). So sánh lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g propane C3H8(g) với lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzene C6H6(l).
Giải:
Áp dụng công thức biến thiên enthalpy chuẩn của một phản ứng hoá học (∆r H0298) khi biết các giá trị ∆f H0298 của tất cả các chất đầu và sản phẩm theo công thức sau:
∆r H0298 = ∆f H0298 (sp) – ∆f H0298 (bđ)
- Xét phản ứng C6H6(l) + 15/2 O2(g) → 6CO2(g) + 3H2O(l)
∆r H0298 = ∆f H0298 (sp) – ∆f H0298 (bđ)
= 6 x ∆f H0298 (CO2) + 3 x ∆f H0298 (H2O) – ∆f H0298 (C6H6) – 15/2 x ∆f H0298 (O2)
= 6 x (-393,50) + 3 x (-285,84) – (+49,00) – 15/2.0
= -3267,52 kJ
Ta có: 1,0 g benzene = 1/78 (mol)
⇨ Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g benzene = -3267,52 . 1/78 = -41,89 kJ
- Xét phản ứng C3H8(g) + 5O2(g) → 3CO2(g) + 4CO2(l)
∆r H0298 = 3 x ∆f H0298 (CO2) + 4 x ∆f H0298 (CO2) – ∆f H0298 (C3H8) - 5 x ∆f H0298 (O2)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
Ta có: 1,0 g C3H8 = 1/44 (mol)
⇨ Lượng nhiệt sinh ra khi đốt cháy hoàn toàn 1,0 g C3H8 = -2218,86 . 1/44 = -50,43 kJ
=> Lượng nhiệt sinh ra khi đốt cháy 1,0 g propane nhiều hơn khi đốt cháy 1,0 g benzene
Bài 3. Dựa vào enthalpy tạo thành ở Bảng 13.1, tính biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm:
2Al(s) + Fe2O3(s) (t0 V2O5) →2Fe(s) + Al2O3(s)
Từ kết quả tính được ở trên, hãy rút ra ý nghĩa của dấu và giá trị ∆r H0298 đối với phản ứng.
2.0 + 1x(-1676,00) – 2.0 – 1x(-825,50)
= -850,50 kJ < 0
- Phản ứng nhiệt nhôm diễn ra sẽ sinh ra lượng nhiệt lớn là 850,50 kJ.
- Giá trị ∆r H0298 càng âm sẽ càng thuận lợi cho phản ứng xảy ra.
Bài 4. Cho phương trình nhiệt hoá học sau:
SO2(g) + 1/2O2(g) (t0 V2O5) → SO3(g) r ∆r H0298 = –98,5 kJ
a) Tính lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3.
b) Giá trị ∆r H0298 của phản ứng: SO3(g) → SO2(g) + 1/2 O2(g) là bao nhiêu?
Giải:
a)
- Mol của 74,6 g SO2 = 74,6/64 = 373/320 (mol)
+ Dùng 1 mol SO2 chuyển hóa thành 1 mol SO3 sinh ra lượng nhiệt là 98,5 kJ
+ Chuyển 373/320 mol SO2 thành SO3 sinh ra lượng nhiệt là
∆r H0298 = 98,5 x 373/320 = 114,81 kJ
⇨ Lượng nhiệt giải phóng ra khi chuyển 74,6 g SO2 thành SO3 là 114,81 kJ.
b) Giá trị ∆r H0298 của phản ứng: SO3(g) → SO2(g) + 1/2 O2(g)
∆r H0298 = ∆f H0298 (sp) – ∆f H0298 (bđ)
= ∆f H0298 (SO2) + 1/2 x ∆f H0298 (O2) - ∆f H0298 (SO3)
= +98,5 kJ
Bài 5. Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hoá học sau:
2H2(g) + O2(g) → 2H2O(g) ∆r H0298 = –483,64 kJ
a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích.
b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen.
Giải:
a) Do ∆r H0298 < 0 (∆r H0298 = –483,64 kJ) nên nước có năng lượng thấp hơn hỗn hợp của oxygen và hydrogen.
b)
 |
| Sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen |
Bài 6. Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) (t0)→3CO2(g) + 4H2O(g)
Tính biến thiên enthalpy chuẩn của phản ứng dựa vào nhiệt tạo thành của hợp chất (Bảng 13.1) và dựa vào năng lượng liên kết (Bảng 14.1). So sánh hai giá trị đó và rút ra kết luận
Giải:
- Dựa vào nhiệt tạo thành:
∆r H0298 = ∆f H0298 (sp) – ∆f H0298 (bđ)
= 3 x ∆f H0298 (CO2) + 4 x ∆f H0298 (H2O) - ∆f H0298 (C3H8) - ∆f H0298 (O2)
= 3.(-393,50) + 4.(-285,84) – (-105,00) – 5.0
= -2218,86 kJ
- Dựa vào năng lượng liên kết:
∆r H0298 = ΣEb(cđ) - ΣEb(sp)
= Eb(C3H8) + 5xEb(O2) – 3xEb(CO2) – 4xEb(H2O)
= 2xEb(C-C) + 8xEb(C-H) + 5xEb(O=O) – 3x2xEb(C=O) – 4.2xEb(O-H)
= 2x347 + 8x413 + 5x498 – 6x745 – 8x467 = -1718 kJ






















0 Nhận xét