Bảng tuần hoàn các nguyên tố hóa học là một trong những công bỗ vĩ đại của môn hóa học. Bảng tuần hoàn mang đến nhiều kiến thức về nguyên tố hóa học theo một hệ thống liên kết chặt chẽ với nhau. Dựa vào bảng tuần hoàn các nguyên tố hoá học, chúng ta có thể giải thích được xu hướng biến đổi tính chất hoá học cơ bản của nguyên tử các nguyên tố không? Mời các bạn cùng trải nghiệm xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố, thành phần và một số một số tính chất của hợp chất trong chu kì và nhóm nhé!
 |
| Xu hướng biến đổi tuần hoàn của các nguyên tố trong bảng tuần hoàn |
1. Bán kính nguyên tử
Bán kính nguyên tử của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
- Trong một chu kì, nguyên tử của các nguyên tố có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên electron lớp ngoài cùng sẽ bị hạt nhân hút mạnh hơn, vì vậy bán kính nguyên tử của các nguyên tố có xu hướng giảm dần.
- Trong một nhóm, theo chiều từ trên xuống dưới, số lớp electron tăng dần nên bán kính nguyên tử có xu hướng tăng.
 |
| Bán kính nguyên tử của một số nguyên tố nhóm A |
2. Độ âm điện
- Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi tạo thành liên kết hoá học.
 |
| Độ âm điện của một nguyên tử |
- Độ âm điện của nguyên tử các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng cũng tăng. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
 |
| Xu hướng biến đổi độ ẩm điện của các nguyên tử trong bảng tuần hoàn |
3. Tính kim loại, tính phi kim
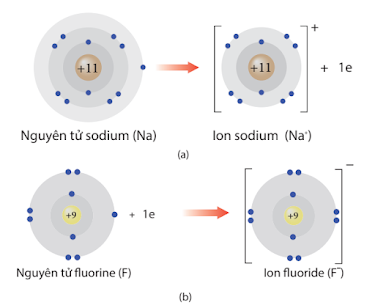
- Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
- Tính phi kim là tính chất của một nguyên tố mà nguyêntử dễ nhận electron.
Quá trình nhường, nhận electron của nguyên tử sodium và fluorine |
Tính kim loại, tính phi kim của các nguyên tố nhóm A có xu hướng biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng tăng. Do đó, tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, tính kim loại của các nguyên tố tăng dần, tính phi kim giảm dần.
4. Tính Acid - Base của Oxide và Hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, tính acid của chúng tăng dần.
 |
| Tính acid – base của oxide và hydroxide của một số nguyên tố nhóm A |
Hướng dẫn giải bài tập
Bài 1. Nguyên tử của nguyên tố nào sau đây có bán kính nhỏ nhất?
A. Si (Z = 14) B. P (Z = 15)
C. Ge (Z = 32) D. As (Z = 33)
Giải:
Tra bảng tuần hoàn ta có;
Si (Z = 14) thuộc chu kì 3, nhóm IVA
P (Z = 15) thuộc chu kì 3 nhóm VA
Ge (Z = 32) thuộc chu kì 4, nhóm IVA
As (Z = 33) thuộc chu kì 4, nhóm VA
Theo xu hướng biến đổi bán kính nguyên tử:
Trong chu kì: Si > P và Ge > As
Trong nhóm: Si < Ge và P < As
⇨ Do đó Ge > As > Si > P
⇨ Chọn đáp án B
Bài 2. Bốn nguyên tố D, E, M, Q cùng thuộc một nhóm A trong bảng tuần hoàn, có số hiệu nguyên tử lần lượt là 9, 17, 35, 53. Các nguyên tố này được sắp xếp theo chiều tính phi kim tăng dần theo dãy nào sau đây?
A. D, Q, E, M B. Q, M, E, D
C. D, E, M, Q D. D, M, E, Q
Giải:
Theo chiều tăng của điện tích hạt nhân (9, 17, 35, 53) thì D, E, M, Q cùng một nhóm VIIA. Theo xu hướng biến đổi tuần hoàn, thì tính phi kim Q < M < E < D.
⇨ Cho nên chọn đáp án B.
Bài 3: Xét ba nguyên tố có cấu hình electron lần lượt:
X: 1s22s22p63s1 Q: 1s22s22p63s2 Z: 1s22s22p63s23p1
Tính base tăng dần của các hydroxide là
| A. XOH < Q(OH)2 < Z(OH)3 |
B. Z(OH)3 < XOH < Q(OH)2
C. Z(OH)3 < Q(OH)2 < XOH
D. XOH < Z(OH)3 < Q(OH)2
Bài 4. Trong bảng tuần hoàn các nguyên tố hoá học, cho biết nguyên tố nào có tính phi kim mạnh nhất. Giải thích.
Giải:
- F có có tính phi kim mạnh nhất bởi vì:
+ Nguyên tố F có độ âm điện lớn nhất trong bảng tuần hoàn ( F = 3,98) thì khả năng hút electron rất mạnh nên thể hiện tính phi kim mạnh nhất
Bài 5. Cho bảng số liệu sau:
Hãy vẽ đồ thị hoặc biểu đồ đối với hai đại lượng bán kính nguyên tử và độ âm điện trong bảng số liệu trên. Quan sát và cho biết hai đại lượng này biến thiên như thế nào? Giải thích.Giải:
+ Bán kính nguyên tử tăng dần
+ Độ âm điện giảm dần
Vì các nguyên tố trên cùng thuộc nhóm IA, và số lớp electron tăng dần từ trên xuống dưới
nên bán kính nguyên tử có xu hướng tăng và
Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng nhanh, lực hút giữa hạt nhân với các electron lớp ngoài cùng giảm. Do đó, độ âm điện của nguyên tử các nguyên tố có xu hướng giảm dần.
























0 Nhận xét