Trong nguyên tử, các electron chuyển động như thế nào và chiếm những mức năng lượng nào? Trình tự sắp xếp các mức năng lượng này ra sao? Việc phân bố các electron trong nguyên tử tuân theo những nguyên lí và quy tắc nào? Cùng Blog khám phá cấu tạo lớp vỏ electron nguyên tử nhé!

cấu tạo lớp vỏ electron nguyên tử
1. Sự chuyển động của các electron trong nguyên tử
1.1. Tìm hiểu sự chuyển động của electron trong nguyên tử
- Theo mô hình nguyên tử của Rutherfor- Bohr, các electron chuyển động theo quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân
- Theo mô hình hiện đại, trong nguyên tử các electron chuyển động rất nhanh xung quanh hạt nhân không theo một vĩ đạo xác định, tạo thành đám mây electron.
 |
| Mô hình nguyên tử theo Rutherford – Bohr - Hiện đại |
1.2. Tìm hiểu về orbital nguyên tử
- Các electron chuyển động rất nhanh xung quanh hạt nhân với xác suất tìm thấy không giống nhau, tạo thành đám mây electron. Khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90% gọi là orbital nguyên tử.
- Orbital nguyên tử (Atomic Orbital, viết tắt là AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác xuất tìm thấy electron là lớn nhất (khoảng 90%).
- Dựa trên sự khác nhau về hình dạng và sự định hướng trongkhông gian của các orbital, phân loại AO thành: s,p,d,f.
- Các AO có hình dạng khác nhau:
+ AO s có dạng hình cầu
+ AO p có dạng hình số 8 nổi
+ AO d và f có hình dạng phức tạp
 |
| Hình dạng của các orbital s và p |
2. Lớp và phân lớp electron
2.1. Tìm hiểu về lớp electron
- Trong nguyên tử, các electron được sắp xếp thành từng lớp (kí hiệu K,L,M,N,O,P,Q) từ gần đến xa hạt nhân, theo thứ tự từ lớp n=1 đến n=7.
- Các electron trên cùng một lớp có năng lượng gần bằng nhau.
2.2. Tìm hiểu về phân lớp electron
- Mỗi lớp electron phân chia thành các phân lớp, được kí hiệu bằng các chữ cái viết thường:s,p,d,f. Các electron thuộc các phân lớp s,d,p,f được gọi tương ứng là các electron s,p,d và f.
- Các phân lớp s,p,d và f lần lượt có các AO tương ứng là 1,3,5 và 7.
- Các electron trên cùng một phân lớp có năng lượng bằng nhau.Với 4 lớp đầu (1,2,3,4) số phân lớp trong mỗi lớp bằng số thứ tự của lớp đó.
 |
| Quy tắc phân bố electron theo thứ tự năng lượng |
3. Cấu hình electron nguyên tử
3.1. Tìm hiểu về nguyên lí vững bền
- Ở trạng thái cơ bản, các electron nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p ... |
| Nguyên lí vững bền |
3.2. Tìm hiểu nguyên lí Pauli (Pau-li)
- Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
- Ô lượng tử là ô vuông được sử dụng để biểu diễn orbital nguyên tử.
- Nếu AO chỉ chứa 1 electron thì electron đó được gọi là electron độc thân
- Nếu AO chứa đầy đủ 2 electron thì các electron đó được gọi là electron ghép đôi.
 |
| Nguyên lí Pauli
|
3.3. Xác định số AO và số electron tối đa trong một phân lớp và trong mỗi lớp
- Số electron tối đa trong lớp n là 2n2 (N ≥ 4)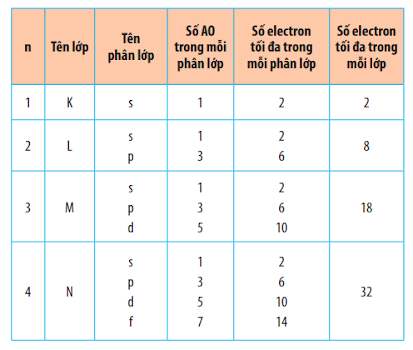 |
| Số AO và số electron tối đa của các lớp |
3.4. Tìm hiểu quy tắc Hund (Hun)
- Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
- Các phân lớp s2 p 6 d10 f14 chứa đủ các electron tối đa gọi là phân lớp bão hòa
- Các phân lớp s1 p 3 d5 f7 chứa một nữa số electron tối đa gọi là phân lớp nữa bão hòa
- Các phân lớp chưa đủ các electron tối đa gọi là phân lớp chưa bão hòa.
 |
| Sự phân bố electron vào các AO trong phân lớp p
|
 |
| Ví dụ quy tắc Hund của nguyên tử carbon |
3.5. Tìm hiểu cách viết cấu hình electron nguyên tử
🌞🌞🌞 Cách viết cấu hình electron nguyên tử:
 |
| Quy ước cách biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp |
− Bước 1: Xác định số electron của nguyên tử.
− Bước 2: Các electron được phân bố theo thứ tự AO có mức năng lượng tăng dần theo nguyên lí và quy tắc phân bố electron nguyên tử.
− Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron.
- Cấu hình electron nguyên tử phải được viết theo thứ tự các lớp electron và phân lớp trong mỗi lớp. Trong đó:
+ Số thứ tự lớp electron được viết bằng các số tự nhiên (n=1, 2, 3, ...)
+ Phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f.
+ Số electron của từng phân lớp được ghi bằng chữ số ở phía trên, bên phải kí hiệu của phân lớp.
3.6. Tìm hiểu đặc điểm cấu hình electron lớp ngoài cùng của nguyên tử
Hướng dẫn giải bài tập
- Chọn (1) thỏa mãn vì chứa tối đa electron độc thân, các electron độc thân được biểu diễn bằng mũi tên hướng lên trên.
a) Boron
b) Oxygen
c) Phosphorus
d) Chlorine

























0 Nhận xét