Một trong những liên kết hóa học thường gặp trong hóa học là liên kết Hydrogen (hay liên kết hidro). Liên kết hóa học này thường gặp trong các chất hóa học quen thuộc trong đời sống như nước, rượu, amoniac,.... Vậy liên kết hidrogen là gì? Đặc điểm của liên kết này là gì? Liên kết hóa học này có mấy loại? Ngoài ra, bài viết còn chia sẽ một số liên kết hydrogen thường gặp trong cuộc sống.
1. Liên kết hydrogen là gì?
Liên kết hidro (hydrogen bond) là một loại liên kết hóa học được hình thành từ lực hút tĩnh điện chủ yếu giữa nguyên tử Hidro (H) liên kết cộng hóa trị với một nguyên tử hoặc nhóm nguyên tử có độ âm điện cao hơn.
 |
| liên kết Hydrogen |
- Liên kết hydrogen là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác có độ âm điện lớn (thường là F, O, N) còn cặp electron hoá trị chưa tham gia liên kết.
2. Đặc điểm liên kết hydrogen
- Lực hút yếu giữa các phân tử
Làm thay đổi tính chất vật lý của phân tử. Ví dụ, nó làm tăng nhiệt độ nóng chảy và sôi của một chất, do đó làm cho nó ít bay hơi hơn
- Mạnh hơn liên kết Van der Waals yếu, nhưng yếu hơn liên kết ion và cộng hóa trị
- Ảnh hưởng đến sự hòa tan của nhiều chất trong nước
- Chịu trách nhiệm về độ nhớt cao và sức căng bề mặt của các chất
3. Các loại liên kết hydrogen
3.1. Liên kết hydro nội phân tử
Liên kết hydrogen nội phân tử xảy ra trong một phân tử. Nó xảy ra khi hai nhóm chức của một phân tử có thể tạo liên kết hydrogen với nhau. Để điều này xảy ra, cả chất cho hydro và chất nhận hydro phải có trong một phân tử. Chúng phải ở gần nhau.
Một ví dụ xảy ra trong axit salicylic. Nhóm ancol (-OH) trên vòng thu hút nhóm axit cacboxylic (oxi liên kết đôi). Liên kết hydrogen giữa các phân tử cũng xảy ra giữa các cặp bazơ DNA.
 |
| Liên kết hidrogen trong phân tử salicylic acid |
3.2. Liên kết hydro giữa các phân tử
Liên kết hydrogen liên phân tử xảy ra giữa hai hoặc nhiều phân tử riêng biệt trong một chất. Chất cho và chất nhận hydrogen có mặt ở những vị trí mà họ có thể tương tác. Độ bền của liên kết hydrogen giữa các phân tử thường được ước tính bằng cách đo độ cân bằng giữa các phân tử chứa đơn vị cho và nhận trong dung dịch.
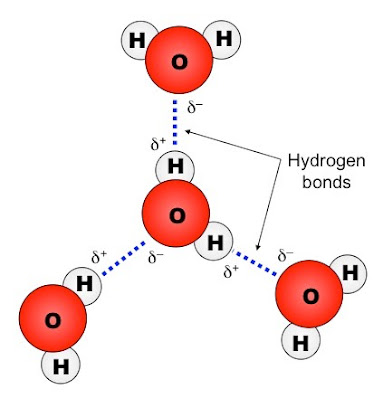 |
| Liên kết hydrogen trong phân tử nước |
4. Một số ví dụ về liên kết hydrogen
Axit flohidric (HF): Axit flohiđric tạo thành cái được gọi là liên kết hydro đối xứng, trong đó proton nằm giữa hai nguyên tử giống hệt nhau. Liên kết hydro đối xứng mạnh hơn liên kết hydro thông thường. Nó có thể so sánh với độ bền của một liên kết cộng hóa trị.
Amoniac (NH3): Liên kết hydro giữa các phân tử hình thành giữa hydro của một phân tử này và nitơ của một phân tử khác. Trong trường hợp của amoniac, liên kết hình thành rất yếu vì mỗi nitơ có một cặp electron duy nhất. Loại liên kết hydro với nitơ này cũng xảy ra trong metylamin.
Acetylacetone (C5H8O2): Liên kết hydro nội phân tử xảy ra giữa hydro và oxy.
DNA: Liên kết hydro hình thành giữa các cặp bazơ. Điều này tạo cho DNA hình dạng chuỗi xoắn kép và làm cho khả năng sao chép của các sợi, khi chúng “giải nén” dọc theo các liên kết hydro.
 |
| Liên kết hydrogen hình thành giữa các cặp bazơ trong DNA |
Phân tử nước: chứa một nguyên tử oxy có độ âm điện cao liên kết với 2 nguyên tử hydro. Nguyên tử oxy thu hút các cặp electron dùng chung nhiều hơn và phần cuối này của phân tử trở nên âm trong khi nguyên tử hydro trở nên dương.
Protein: Các liên kết hydro nội phân tử dẫn đến sự gấp khúc của protein, giúp phân tử duy trì sự ổn định và có cấu hình chức năng.
Polyme: Polyme có chứa nhóm cacbonyl hoặc amit tạo thành liên kết hydro. Ví dụ bao gồm urê và polyurethane và polyme cellulose tự nhiên. Liên kết hydro trong các phân tử này làm tăng độ bền kéo và điểm nóng chảy của chúng.
Rượu: Etanol và các rượu khác chứa liên kết hydro giữa hydro và oxy.
Lời kết
Trên đây là những khái niệm liên quan đến liên kết Hydrogen. Bài viết chia sẽ kiến thức hóa học cơ bản về liên kết hóa học và một số ví dụ về liên kết hydrogen. Hi vọng bài viết này hữu ích với các bạn. Chúc các bạn thành công!






















0 Nhận xét